Pembahasan Kimia No. 36 - 40 TKD Saintek SBMPTN 2016 Kode Naskah 225
Jumat, 25 Mei 2018
Tambah Komentar
Pembahasan soal Kimia Tes Kemampuan Dasar Sains dan Teknologi (TKD
Saintek) Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN) tahun
2016 kode naskah 225 nomor 36 sampai dengan nomor 40 tentang:
- energetika,
- reaksi reduksi dan oksidasi,
- elektrolisis,
- kecepatan reaksi, serta
- kesetimbangan reaksi.
Soal No. 36 tentang Energetika
Energi ikatan rata-rata C-N, O-H, dan C=O berturut-turut adalah 305, 467, dan 745 kJ.mol−1.CO2(g) + 2NH3(g) → (NH2)2CO(g) + H2O(g) ΔH = −17 kJ.mol−1
Energi ikatan rata-rata N-H dalam kJ.mol−1 adalah ….
A. 391
B. 782
C. 945
D. 1527
E. 2346
Energi ikatan rata-rata N-H dalam kJ.mol−1 adalah ….
A. 391
B. 782
C. 945
D. 1527
E. 2346
Pembahasan
Untuk mempermudah memahami soal di atas, ada baiknya kita gambar struktur ikatannya.
CO2 + 2NH3 → (NH2)2CO + H2O

Perubahan entalpi reaksi di atas adalah:
ΔH = energi ruas kiri – energi ruas kanan
−17 = 2CO + 6NH − (4NH + 2CN + CO + 2OH)
−17 = CO + 2NH − 2CN − 2OH
−17 = 745 + 2NH − 2×305 − 2×467
−17 = 2NH − 799
2NH = 782
NH = 391
−17 = 2CO + 6NH − (4NH + 2CN + CO + 2OH)
−17 = CO + 2NH − 2CN − 2OH
−17 = 745 + 2NH − 2×305 − 2×467
−17 = 2NH − 799
2NH = 782
NH = 391
Jadi, energi ikatan rata-rata N-H adalah 391 kJ.mol−1 (A).
Soal No. 37 tentang Reaksi Reduksi dan Oksidasi
Dalam suasana basa, Cl2 mengalami reaksi disproporsionasi menghasilkan ion Cl− dan ClO3−. Jumlah mol ion ClO3− yang dihasilkan dari 1 mol Cl2 adalah ….A. 1/5
B. 1/3
C. 1/2
D. 1
E. 2
B. 1/3
C. 1/2
D. 1
E. 2
Pembahasan
Kunci
penyelesaian soal ini adalah mengingat kembali langkah-langkah
menyetarakan reaksi redoks. Metode yang paling praktis dalam
menyetarakan reaksi redoks adalah metode perubahan biloks karena metode
ini bisa dilakukan baik pada suasana asam maupun basa.
Mari kita setarakan reaksi di atas!
Cl2 mengalami reaksi disproporsionasi (autoredoks) menghasilkan ion Cl− dan ClO3−.
Cl2 → Cl− + ClO3−
Langkah pertama kita cari biloks selain H dan O, yaitu biloks dari Cl
(ingat, biloks O = −2). Kemudian kita cari perubahan biloks-nya.
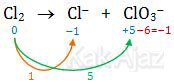
Selanjutnya kita kalikan silang perubahan tersebut, 5 kita kalikan pada Cl− dan 1 kita kalikan ke ClO3−.
Cl2 → 5Cl− + 1ClO3−
Akibatnya, jumlah Cl di ruas kanan menjadi 6. Agar sama, ruas kiri kita kalikan 3. Diperoleh:
3Cl2 → 5Cl− + 1ClO3−
Penyetaraan bisa dilanjutkan dengan menyetarakan jumlah atom O dan
jumlah muatan. Namun, itu tidak perlu kita lakukan karena pertanyaannya
bukan penyetaraan.
Perhatikan pertanyaan pada soal!
Jumlah mol ion ClO3− yang dihasilkan dari 1 mol Cl2 adalah…Karena kita sudah mendapatkan koefisien reaksi maka jumlah mol ClO3− dapat ditentukan melalui perbandingan koefisien.
mol ClO3− = 1/3 mol Cl2
= 1/3× 1 mol
= 1/3 mol
= 1/3× 1 mol
= 1/3 mol
Jadi, jumlah mol ion ClO3− yang dihasilkan dari 1 mol Cl2 adalah 1/3 mol (B).
Soal No. 38 tentang Elektrolisis
Nilai potensial reduksi beberapa ion diberikan di bawah ini.Cu2+(aq) + 2e− → Cu(s) E0 = +0,340 V
2H+(aq) + 2e− → H2(g) E0 = 0,000 V
Pb2+(aq) + 2e− → Pb(s) E0 = −0,126 V
Fe2+(aq) + 2e− → Fes) E0 = −0,440 V
2H2O(l) + 2e− → H2(g) + 2OH−(aq) E0 = −0,830 V
Arus listrik sebesar 10 mA dialirkan pada sel elektrolisis. Pada sel elektrolisis ini katoda dicelupkan ke dalam larutan yang mengandung ion Cu2+, H+, Pb2+, dan Fe2+ dengan konsentrasi masing-masing 0,1 M. Spesi yang pertama kali terbentuk pada katoda adalah ….
A. H2
B. OH−
C. Cu
D. Pb
E. Fe
2H+(aq) + 2e− → H2(g) E0 = 0,000 V
Pb2+(aq) + 2e− → Pb(s) E0 = −0,126 V
Fe2+(aq) + 2e− → Fes) E0 = −0,440 V
2H2O(l) + 2e− → H2(g) + 2OH−(aq) E0 = −0,830 V
Arus listrik sebesar 10 mA dialirkan pada sel elektrolisis. Pada sel elektrolisis ini katoda dicelupkan ke dalam larutan yang mengandung ion Cu2+, H+, Pb2+, dan Fe2+ dengan konsentrasi masing-masing 0,1 M. Spesi yang pertama kali terbentuk pada katoda adalah ….
A. H2
B. OH−
C. Cu
D. Pb
E. Fe
Pembahasan
Soal ini hanya panjang kalimat tetapi jawabannya mudah ditebak.
Perhatikan konsep berikut!
katoda : terjadi reaksi reduksi (E0 besar)
anoda : terjadi reaksi oksidasi (E0 kecil)
anoda : terjadi reaksi oksidasi (E0 kecil)
Jika suatu spesi mempunyai potensial reduksi yang lebih besar dari yang lain maka spesi tersebut cenderung mengalami reduksi.
Pada soal di atas, Cu2+ mempunyai potensial reduksi paling besar. Sehingga Cu2+ akan mengalami reduksi lebih dahulu membentuk endapan Cu.
Cu2+(aq) + 2e− → Cu(s)
Jadi, spesi yang pertama kali terbentuk pada katoda adalah Cu (C).
Soal No. 39 tentang Kecepatan Reaksi
Berdasarkan reaksi berikut:H2S(g) + SO2(g) → S(s) + H2O(l) (belum setara)
laju pengurangan H2S(g) per satuan waktu dibandingkan dengan laju pertambahan S(s) per satuan waktu adalah ….
laju pengurangan H2S(g) per satuan waktu dibandingkan dengan laju pertambahan S(s) per satuan waktu adalah ….
A. 1 : 1
B. 1 : 3
C. 2 : 1
D. 2 : 3
E. 3 : 1
B. 1 : 3
C. 2 : 1
D. 2 : 3
E. 3 : 1
Pembahasan
Reaksi pada soal di atas bila disetarakan akan menjadi:
2H2S + SO2 → 3S + 2H2O
Sementara itu, laju reaksi sebanding dengan koefisien reaksi.
laju reaksi ~ koefisienSehingga diperoleh:
vH2S : vS = 2 : 3
Jadi, perbandingan laju pengurangan H2S(g) terhadap laju pertambahan S(s) per satuan waktu adalah 2 : 3 (D).
Soal No. 40 tentang Kesetimbangan Reaksi
Gas oksigen difluorida (OF2) disintesis dari reaksi antara gas F2 dengan gas O2 menurut reaksi berikut:2F2(g) + O2(g) ⇌ 2OF2(g)
Dalam sebuah wadah dengan volume tertentu, tekanan awal gas F2 dan gas O2 diketahui masing-masing 1 atm. Jika pada kesetimbangan tekanan total gas adalah 1,75 atm maka nilai Kp reaksi tersebut adalah ….
A. 0,133
B. 0,278
C. 0,555
D. 0,755
E. 1,333
Dalam sebuah wadah dengan volume tertentu, tekanan awal gas F2 dan gas O2 diketahui masing-masing 1 atm. Jika pada kesetimbangan tekanan total gas adalah 1,75 atm maka nilai Kp reaksi tersebut adalah ….
A. 0,133
B. 0,278
C. 0,555
D. 0,755
E. 1,333
Pembahasan
Misalkan gas O2 yang bereaksi adalah x atm (kita pilih gas O2 karena koefisiennya 1).
| 2F2(g) | + O2(g) | ⇌ 2OF2(g) | ||
| mula-mula | : | 1 | 1 | - |
| reaksi | : | 2x | x | 2x |
| setimbang | : | 1 − 2x | 1 − x | 2x |
Pada keadaan setimbang, tekanan total gas adalah 1,75 atm.
(1 − 2x) + (1 − x) + 2x = 1,75
2 − x = 1,75
x = 2 − 1,75
= 0,25
2 − x = 1,75
x = 2 − 1,75
= 0,25
Berdasarkan nilai x ini, kita tentukan tekanan parsial masing-masing gas pada keadaan setimbang.
PF2 = 1 − 2x
= 1 − 2×0,25
= 0,5
= 1 − 2×0,25
= 0,5
PO2 = 1 − x
= 1 − 0,25
= 0,75
= 1 − 0,25
= 0,75
POF2 = 2x
= 2×0,25
= 0,5
= 2×0,25
= 0,5
Dengan demikian, harga Kp adalah:

Jadi, tetapan kesetimbangan tekanan reaksi tersebut adalah 1,333 (E).


Belum ada Komentar untuk "Pembahasan Kimia No. 36 - 40 TKD Saintek SBMPTN 2016 Kode Naskah 225"
Posting Komentar