Pembahasan Kimia No. 31 - 35 TKD Saintek SBMPTN 2016 Kode Naskah 225
Jumat, 25 Mei 2018
Tambah Komentar
Pembahasan soal Kimia Tes Kemampuan Dasar Sains dan Teknologi (TKD
Saintek) Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN) tahun
2016 kode naskah 225 nomor 31 sampai dengan nomor 35 tentang:
- kimia unsur,
- bentuk molekul,
- konsep mol,
- pereaksi pembatas, dan
- stoikiometri.
Soal No. 31 tentang Kimia Unsur
Nilai energi pengionan ke-1 sampai ke-5 untuk unsur X pada golongan
utama berturut-turut adalah 509, 979, 3300, 4400, dan 5700 kJ.mol−1. Berdasarkan data tersebut, dapat disimpulkan bahwa unsur X cenderung membentuk ion ….
A. X+1
B. X+2
C. X+3
D. X+4
E. X+5
B. X+2
C. X+3
D. X+4
E. X+5
Pembahasan
Energi pengionan atau energi ionisasi adalah energi yang dibutuhkan oleh suatu atom untuk melepas elektron.
Jika untuk melepas 1 elektron dibutuhkan energi yang besar maka suatu atom cenderung tidak melepas elektron. Sebaliknya, jika energi ionisasinya kecil maka atom akan cenderung melepas elektron.
Ibarat membeli suatu barang, seseorang cenderung melepas uangnya untuk barang yang lebih murah.
Perhatikan grafik energi pengionan atom X berikut ini.

Energi ionisasi (EI) ke-1 dan ke-2 jauh lebih kecil daripada EI ke-3, ke-4, dan ke-5.
Mula-mula atom X melepas 1 elektron dengan menggunakan EI ke-1 menjadi X+. Karena EI ke-2 masih relatif kecil, atom X melepas 1 elektron lagi menjadi X+2.
Sedangkan EI ke-3 sangat besar (lebih dari 3 kali lipat) sehingga atom X tidak melepas elektron lagi.
Jadi, unsur X cenderung membentuk ion X+2 (B).
Soal No. 32 tentang Bentuk Molekul
Senyawa kovalen X2Y terbentuk dari atom dengan nomor
atom X dan Y berturut-turut 17 dan 8. Bentuk molekul yang sesuai untuk
senyawa kovalen tersebut adalah ….A. linear
B. segitiga datar
C. bentuk V
D. piramida segitiga
E. tetrahedral
B. segitiga datar
C. bentuk V
D. piramida segitiga
E. tetrahedral
Pembahasan
Kita tentukan dulu konfigurasi elektron atom X dan Y.
17X : 2 8 7 (7 elektron terluar)
8Y : 2 6 (6 elektron terluar)
8Y : 2 6 (6 elektron terluar)
Atom X mempunyai 7 elektron terluar sehingga membutuhkan 1 elektron
dari Y agar terpenuhi kaidah oktet (jumlah elektron terluar = 8).
Sedangkan atom Y mempunyai 6 elektron terluar sehingga membutuh 2
elektron dari X.
Senyawa yang terbentuk adalah X2Y atau YX2 sehingga yang menjadi atom pusat adalah Y.

Perhatikan elektron terluar pada atom pusat Y! Dari 6 elektro terluarnya, 2 elektron digunakan untuk mengikat atom X (m = 2). Sisa 4 elektron membentuk 2 pasang elektron bebas (n = 2).
Dengan demikian, tipe molekulnya adalah:
AXmEn → AX2E2
Tipe molekul AX2E2 mempunyai bentuk molekul bentuk V (diketahui dari tabel).
Tabel tipe dan bentuk molekul bisa dilihat di Pembahasan Kimia: Bentuk Molekul.
Jadi, bentuk molekul senyawa kovalen X2Y adalah bentuk V (C).
Soal No. 33 tentang Konsep Mol
Analisis terhadap suatu senyawa menghasilkan rumus empiris NaCO2 (Ar Na = 23, O = 16, dan C = 12). Jika 1 mol senyawa ini mempunyai massa 134 g dan bilangan Avogadro L = 6,02 × 1023 maka jumlah atom karbon dalam 0,1 mol senyawa ini adalah ….A. 1,2 × 1023
B. 6,02 × 1023
C. 3,01 × 1023
D. 3,01 × 1022
E. 6,02 × 1020
B. 6,02 × 1023
C. 3,01 × 1023
D. 3,01 × 1022
E. 6,02 × 1020
Pembahasan
Rumus molekul (RM) merupakan kelipatan bilangan bulat dari rumus empiris. Rumus molekul senyawa tersebut adalah:
RM = (NaCO2)n
Rumus molekul inilah yang digunakan dalam penentuan besar massa molekul relatif (Mr).
Jika 1 mol (NaCO2)n mempunyai massa 134 g maka:
Mr (NaCO2)n = gr/mol
(23 + 12 + 2×16)n = 134/1
67n = 134
n = 2
(23 + 12 + 2×16)n = 134/1
67n = 134
n = 2
Sehingga rumus molekul senyawa tersebut adalah:
(NaCO2)2 → Na2C2O4
Jumlah atom C dalam 0,1 mol senyawa Na2C2O4 adalah:
N = banyak atom C dalam Na2C2O4 × mol × L
= 2 × 0,1 × 6,02 × 1023
= 1,2 × 1023
= 2 × 0,1 × 6,02 × 1023
= 1,2 × 1023
Jadi, jumlah atom karbon dalam 0,1 mol senyawa tersebut adalah 1,2 × 1023 (A).
Soal No. 34 tentang Pereaksi Pembatas
Sebanyak 5,6 g B2H6 direaksikan dengan 4,2 g Cl2 sehingga terjadi reaksi berikut:B2H6(g) + Cl2(g) → BCl3(g) + HCl(g) (belum setara)
Massa HCl (Ar B = 11, H = 1, Cl = 35,5) yang diperoleh dari reaksi tersebut adalah ….
A. 7,3 g
B. 10,95 g
C. 21,9 g
D. 14,6 g
E. 36,5 g
Massa HCl (Ar B = 11, H = 1, Cl = 35,5) yang diperoleh dari reaksi tersebut adalah ….
A. 7,3 g
B. 10,95 g
C. 21,9 g
D. 14,6 g
E. 36,5 g
Pembahasan
Reaksi di atas bila disetarakan akan menjadi:
B2H6 + 6Cl2 → 2BCl3 + 6HCl
Pada soal di atas, kedua pereaksi diketahui massanya. Berarti kita
harus menentukan pereaksi pembatasnya, yaitu pereaksi yang habis
bereaksi.
Kita mulai dengan menentukan mol dari B2H6 dan Cl2.
Mr B2H6 = 2×11 + 6×1
= 28
= 28
mol B2H6 = 5,6/28 mol
= 0,2 mol
= 0,2 mol
Mr Cl2 = 2×35,5
= 71
= 71
mol Cl2 = 4,2/71 mol
= 0,6 mol
= 0,6 mol
Untuk menentukan pereaksi pembatas, masing-masing mol kita bagi
dengan koefisiennya. Yang memberikan hasil lebih kecil akan bertindak
sebagai pereaksi pembatas.
B2H6 → 0,2/1 = 0,2
Cl2 → 0,6/6 = 0,1
Cl2 → 0,6/6 = 0,1
Dengan demikian, yang bertindak sebagai pereaksi pembatas adalah Cl2. Artinya, 0,6 mol Cl2 akan habis bereaksi sedangkan 0,2 mol B2H6 akan tersisa (tidak dapat digunakan sebagai dasar penghitungan).
Berdasarkan pereaksi pembatas ini, kita dapat menentukan mol HCl melalui perbandingan koefisien.
mol HCl = 6/6 × 0,6 mol
= 0,6 mol
= 0,6 mol
Dengan demikian, massa HCl adalah:
gr HCl = mol × Mr
= 0,6 × 36,5
= 21,9
= 0,6 × 36,5
= 21,9
Jadi, massa HCl yang diperoleh dari reaksi tersebut adalah 21,9 g (C).
Soal No. 35 tentang Stoikiometri
Padatan NH4NO3 (Ar N = 14, H = 1, O = 16) jika dipanaskan akan terurai menjadi gas N2O dan uap air menurut reaksi berikut:NH4NO3(s) → N2O(g) + 2H2O(g)
Pemanasan 40 g padatan NH4NO3 menghasilkan 10 L gas N2O. Jika pada kondisi yang sama 10 L gas X memiliki massa 22 g maka massa molekul relatif (Mr) gas X adalah ….
A. 22
B. 44
C. 66
D. 88
E. 110
Pemanasan 40 g padatan NH4NO3 menghasilkan 10 L gas N2O. Jika pada kondisi yang sama 10 L gas X memiliki massa 22 g maka massa molekul relatif (Mr) gas X adalah ….
A. 22
B. 44
C. 66
D. 88
E. 110
Pembahasan
Kita tentukan dulu mol dari pereaksinya.
Mr NH4NO3 = 2×14 + 4×1 + 3×16
= 80
= 80
mol NH4NO3 = 40/80 mol
= 0,5 mol
= 0,5 mol
Karena koefisien N2O sama dengan koefisien NH4NO3 maka jumlah mol keduanya juga sama.
mol N2O = 0,5 mol
Pada kondisi yang sama, gas X memiliki massa 22 gram. Berarti mol gas X sama dengan mol gas N2O.
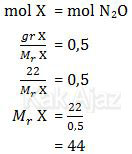
Jadi, massa molekul relatif (Mr) gas X adalah 44 (B).


Belum ada Komentar untuk "Pembahasan Kimia No. 31 - 35 TKD Saintek SBMPTN 2016 Kode Naskah 225"
Posting Komentar