Pembahasan Kimia UN 2017 No. 6 - 10
Jumat, 25 Mei 2018
Tambah Komentar
Pembahasan soal Kimia Ujian Nasional (UN) tahun 2017 nomor 6 sampai dengan nomor 10 tentang:
- sifat ikatan kimia,
- jenis ikatan kimia [kovalen koordinasi],
- bentuk molekul,
- reaksi reduksi dan oksidasi, serta
- reduktor dan oksidator.
Soal No. 6 tentang Sifat Ikatan Kimia
Perhatikan data hasil percobaan berikut!
Jenis ikatan yang terdapat pada zat V dan X secara berturut-turut adalah ….A. ikatan logam dan ikatan ion
B. ikatan logam dan kovalen polar
C. ikatan kovalen polar dan kovalen nonpolar
D. ikatan logam dan ikatan kovalen nonpolar
E. ikatan ion dan kovalen nonpolar
| Zat | Titik leleh (℃) | Kelarutan dalam air | Daya Hantar | |
| Padatan | Lelehan | |||
| V | 1.070 | tidak larut | menghantarkan | menghantarkan |
| X | −6 | tidak larut | tidak menghantarkan | tidak menghantarkan |
Jenis ikatan yang terdapat pada zat V dan X secara berturut-turut adalah ….A. ikatan logam dan ikatan ion
B. ikatan logam dan kovalen polar
C. ikatan kovalen polar dan kovalen nonpolar
D. ikatan logam dan ikatan kovalen nonpolar
E. ikatan ion dan kovalen nonpolar
Pembahasan
Perhatikan sifat senyawa yang disajikan dalam tabel berikut ini!
| ion | kovalen polar | kov. nonpolar | logam | |
| titik leleh | > 800 ℃ | < 800 ℃ | < 800 ℃ | > 800 ℃ |
| dalam air | larut | larut | tak larut | tak larut |
| padatan | isolator | isolator | isolator | konduktor |
| lelehan | konduktor | isolator | isolator | konduktor |
| larutan | konduktor | konduktor | isolator | konduktor |
Berdasarkan tabel di atas dapat disimpulkan bahwa zat V berikatan logam karena titik lelehnya di atas 800 ℃, tidak larut dalam air, dan bersifat konduktor pada semua fase.
Sedangkan zat X berikatan kovalen nonpolar
karena titik lelehnya kurang dari 800 ℃, tidak larut dalam air, dan
bersifat isolator pada semua fase.
Jadi, jenis ikatan yang terdapat pada zat V dan X secara berturut-turut adalah ikatan logam dan kovalen nonpolar (D).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Ikatan Kimia.
Soal No. 7 tentang Jenis Ikatan Kimia [kovalen koordinasi]
Gambar struktur Lewis senyawa SO2 yang paling tepat adalah … (nomor atom S = 16; O = 8).


Pembahasan
Elektron terluar dari unsur S dan O adalah:
16S : 2 8 6
8O : 2, 6
8O : 2, 6
Unsur S dan O mempunyai jumlah elektron terluar yang sama, yaitu 6.
Berarti keduanya membutuh 2 elektron lagi agar terpenuhi kaidah oktet.
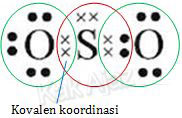
Oleh karena itu, 2 elektron S melakukan kerja sama (kovalen) dengan 2 elektron O (sebelah kanan). Dengan kerja sama ini, elektron terluar S menjadi 8, demikian juga dengan elektron terluar dari O sebelah kanan.
Sementara
itu, untuk mengikat O sebelah kiri, unsur S hanya memberikan 2
elektronnya tanpa menarik elektron dari O (kovalen koordinasi). Hal ini
karena elektron valensi S sudah memenuhi kaidah oktet.
Jadi, gambar struktur Lewis senyawa SO2 yang paling tepat adalah opsi (B).
Perdalam materi ini di Pembahasan Kimia UN: Jenis Ikatan Kimia.
Soal No. 8 tentang Bentuk Molekul
Konfigurasi elektron dari unsur D dan E.D = [He] 2s2 2p5
E = [Ne] 3s2 3p3
Rumus kimia dan bentuk molekul yang terbentuk jika kedua unsur tersebut berikatan adalah ….
A. ED, linear
B. ED5, bipiramida trigonal
C. E2D, linear
D. ED2, planar bentuk V
E. E4D, tetrahedron
E = [Ne] 3s2 3p3
Rumus kimia dan bentuk molekul yang terbentuk jika kedua unsur tersebut berikatan adalah ….
A. ED, linear
B. ED5, bipiramida trigonal
C. E2D, linear
D. ED2, planar bentuk V
E. E4D, tetrahedron
Pembahasan
Elektron valensi (elektron terluar) dari unsur D dan E adalah:
D = [He] 2s2 2p5 [7 elektron valensi]
E = [Ne] 3s2 3p3 [5 elektron valensi]
E = [Ne] 3s2 3p3 [5 elektron valensi]
Agar terpenuhi kaidah oktet (jumlah valensi 8) maka unsur D
membutuhkan 1 elektron dari E sedangkan unsur E membutuhkan 3 elektron
dari D. Sehingga terbentuk ikatan ED3.
Ternyata senyawa ED3 tidak terdapat pada opsi jawaban.
Berarti terbentuknya ikatan tidak berdasarkan kaidah oktet, tetapi
berdasarkan kesimetrisan bentuk molekul.
Agar terbentuk molekul yang simetris maka kelima elektron valensi E berikatan dengan elektron D membentuk molekul ED5.

Karena semua elektron valensi dari unsur E berikatan maka tidak terdapat elektron bebas sehingga mempunyai tipe molekul AX5 dengan bentuk molekul segitiga bipiramida atau trigonal bipiramida.
Jadi, rumus kimia dari terbentuk dari kedua unsur tersebut adalah ED5 dengan bentuk molekul bipiramida trigonal (B).
Perdalam materi ini di Pembahasan Kimia UN: Bentuk Molekul.
Soal No. 9 tentang Reaksi Reduksi dan Oksidasi
Diberikan lima persamaan reaksi oksidasi atau reduksi yang belum setara.
- MnO4− → MnO42−
- SO2 → SO3
- C2H4 → C2H6
- FeO → Fe2O3
- Cl2 + 2e → 2Cl−
A. (1), (2), dan (3)
B. (1), (3), dan (4)
C. (1), (3), dan (5)
D. (2), (3), dan (4)
E. (2), (3), dan (5)
B. (1), (3), dan (4)
C. (1), (3), dan (5)
D. (2), (3), dan (4)
E. (2), (3), dan (5)
Pembahasan
Mari kita tentukan perubahan biloks (selain H dan O) pada masing-masing reaksi!

Jadi, kelompok persamaan reaksi yang mengalami reduksi ditunjukkan oleh nomor 1, 3, dan 5 (C).
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Redoks dan Elektrokimia.
Soal No. 10 tentang Oksidator dan Reduktor
Perhatikan persamaan reaksi redoks berikut!Sn(s) + 4HNO3(aq) → SnO2(s) + 4NO2(g) + 2H2O(l)
Bilangan oksidasi dari zat oksidator dan hasil reduksinya berturut-turut adalah ….
A. +1, Sn
B. +1, SnO2
C. +4, NO2
D. +5, NO2
E. +5, HNO3
Bilangan oksidasi dari zat oksidator dan hasil reduksinya berturut-turut adalah ….
A. +1, Sn
B. +1, SnO2
C. +4, NO2
D. +5, NO2
E. +5, HNO3
Pembahasan
Mari kita perhatikan perubahan biloks masing-masing unsur (selain H dan O).
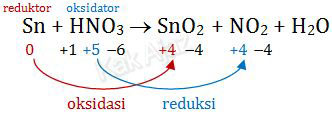
Sn mengalami oksidasi menjadi SnO2 sehingga Sn disebut reduktor sedangkan SnO2 disebut hasil oksidasi.
Sementara itu, HNO3 mengalami reduksi menjadi NO2 sehingga HNO3 disebut oksidator sedangkan NO2 disebut hasil reduksi.
Jadi, bilangan oksidasi dari zat oksidator adalah +5 dan hasil reduksinya adalah NO2 (D).


Belum ada Komentar untuk "Pembahasan Kimia UN 2017 No. 6 - 10"
Posting Komentar